Genetika i dijagnoza
SMA je nasljedna bolest, čiji je genski uzrok dobro definiran.1-3
SMA je autosomno recesivna genska bolest, kod koje je prisutna delecija ili mutacija dvaju gena SMN1 – po jednoga od svakog roditelja.4
Preporučuje se probir nositelja5
Budući da se SMA javlja u cjelokupnoj populaciji, Američki koledž medicinske genetike i genomike (engl. American College of Medical Genetics and Genomics, ACMG) preporučuje da se probirno testiranje ponudi svim parovima, bez obzira na rasu ili etničku pripadnost.
ACMG predlaže da se probir obavi prije začeća ili u ranoj trudnoći kako bi nositelji genske mutacije mogli donijeti svjesne odluke o planiranju obitelji.
Molekularno gensko testiranje važan je alat za dijagnosticiranje spinalne mišićne atrofije.6, 7
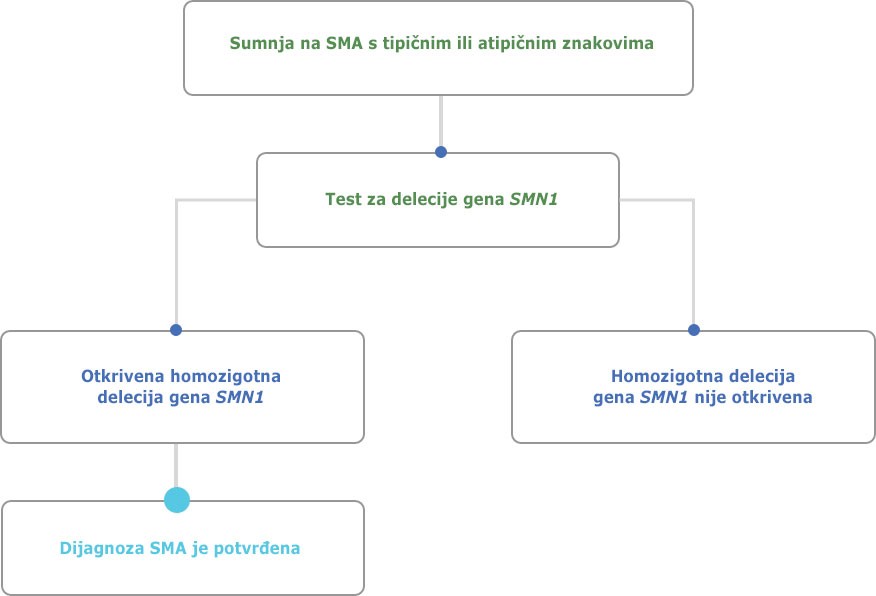
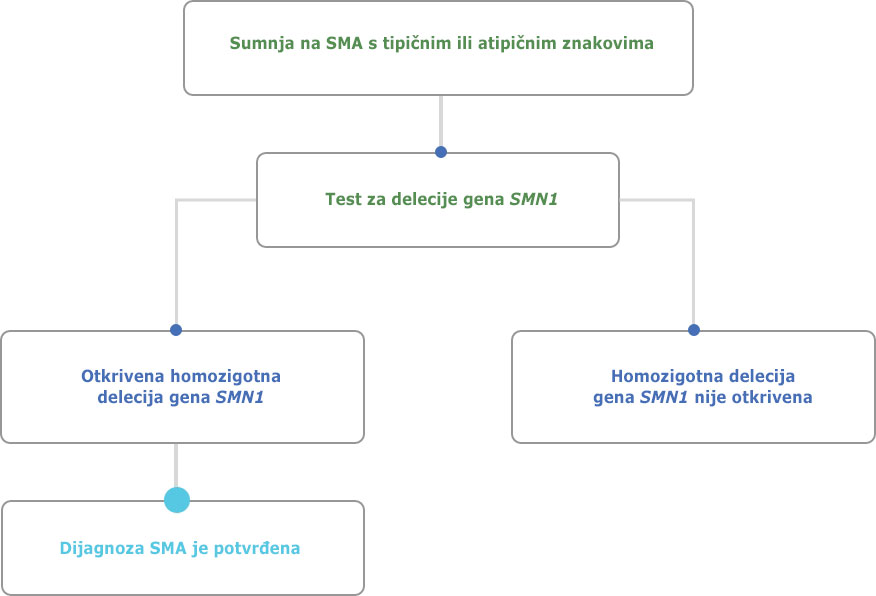
Preuzeto i prilagođeno od: D`Amico et. al.6
Test za utvrđivanje delecije gena SMN preporučuje se kao prvi dijagnostički postupak za bolesnika kod kojega se sumnja na SMA.
Ako se utvrdi da bolesnik ima jednu kopiju gena SMN1, a klinička slika odgovara SMA, daljnjim sekvenciranjem preostalog gena SMN1 mogu se identificirati mutacije i potvrditi dijagnoza SMA.7
Prikazane osobe stvarni su bolesnici i za korištenje njihove priče pribavljena je potrebna suglasnost bolesnika i njihovih obitelji. Fotografije služe samo kao ilustracija.
SMA je posljedica homozigotnih delecija ili mutacija gena SMN na lokusu 5q13 kromosoma 5. Postoji mnogo rijetkih neuromišićnih bolesti (primjerice, Lambert -Eatonov mijastenični sindrom, koji pogađa 0,05 - 0,08 na 100 000 ljudi godišnje).8 Te bolesti mogu uključivati mutacije u različitim genima koji nisu povezani s kromosomom 5q13.
Diferencijalna dijagnoza spinalne mišićne atrofije uzrokovane mutacijom na kromosomu 5q uključuje, ali nije ograničena na sljedeće:9
Bolesti kralježnične moždine
- novotvorine
- ostale mijelopatije
Miopatije
Urođene miopatije:
- urođena miotonična distrofija
- urođene mišićne distrofije
- mišićne distrofije
- mitohondrijske miopatije
- Pompeova bolest
Ostale metaboličke miopatije:
- upalne miopatije
- miopatije ionskih kanala
Neuropatije
- urođena hipomijelinizirajuća ili aksonska neuropatija
- nasljedne motoričke ili osjetilne neuropatije
- kronična upalna demijelinizirajuća polineuropatija
Bolesti mišićno-živčanog spoja
- botulizam
- urođen mijastenički sindrom
- Lambert-Eatonov mijastenički sindrom
- autoimuna mijastenija gravis
Druge bolesti motoričkih neurona
- spinalna mišićna atrofija s respiratornim distresom (SMARD)
- juvenilna mišićna atrofija distalnog gornjeg ekstremiteta (bolest Hirayama)
- Fazio-Londeova bolest
- sindrom Brown-Vialetto-van Laere
- juvenilna amiotrofična lateralna skleroza
- ostale spinalne mišićne atrofije nevezane za kromosom 5q
Druge bolesti
- kromosomske anomalije
- Prader-Willijev sindrom
- anomalije središnjeg živčanog sustava
SMA je autosomno recesivna genska bolest3, 9
Spinalna mišićna atrofija (SMA) monogenska je bolest s čitavim spektrom različitih kliničkih slika koje se razlikuju ovisno o bolesnikovoj dobi pri nastupu bolesti i težini bolesti.7,17 Hipotonija (sindrom „mlohavog dojenčeta“) i/ili mišićna slabost i atrofija najčešći su znakovi ili simptomi bolesti kod djece.7,18
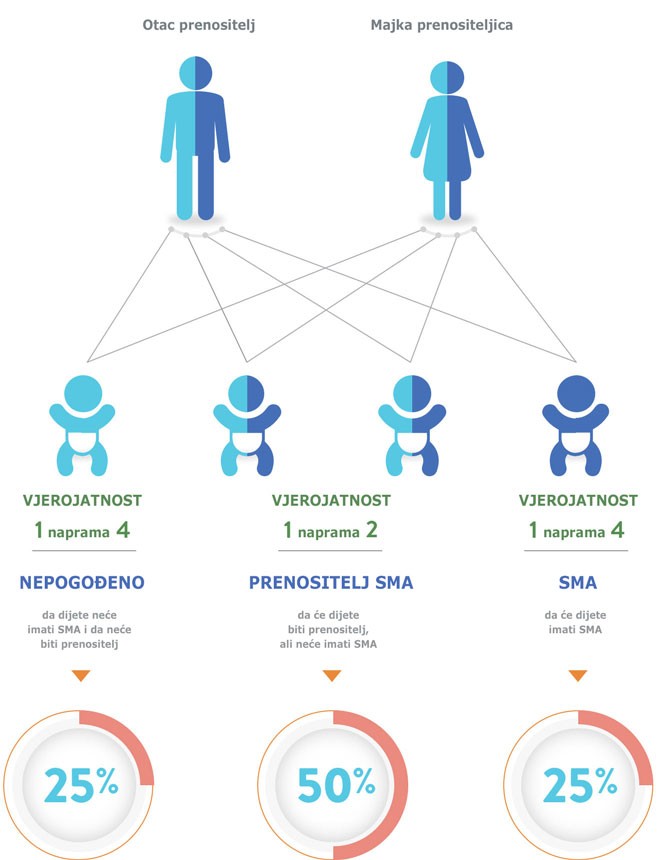
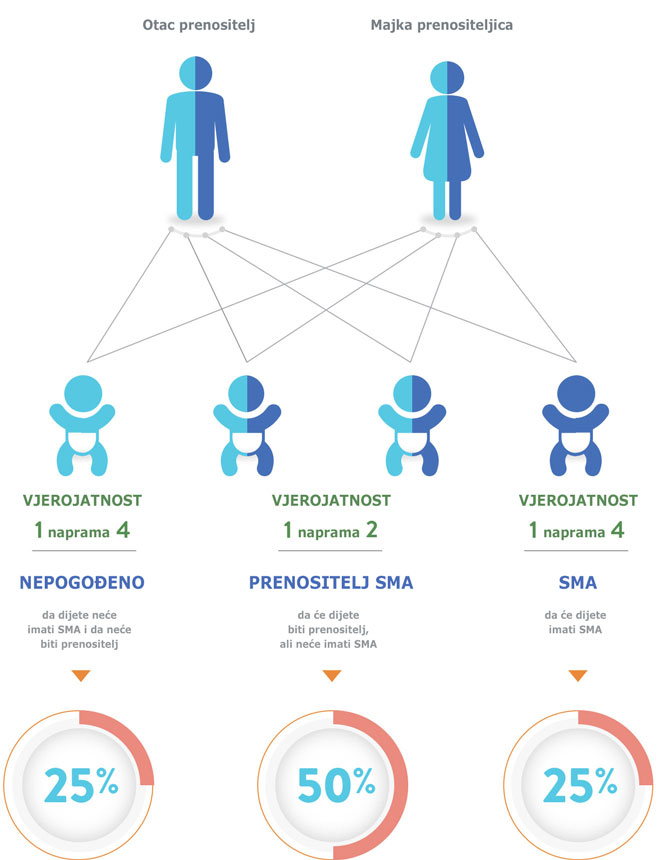
Genska bolest
Dijete nasljeđuje dva nedostajuća ili mutirana gena SMN1 -
po jedan od svakog roditelja.4
Važnost rane dijagnoze
Prirodni tijek SMA uključuje nepovratan gubitak motoričkih funkcija.8 Nakon uobičajenog prvotnog povećanja, početak SMA obilježavaju vrhunac motoričkih sposobnosti i njihovo kasnije opadanje, pri čemu je progresija bolesti (i gubitak motoričkih sposobnosti) najbrža u ranoj fazi.19
Rano postavljanje dijagnoze može biti važan čimbenik u liječenju SMA.20
![]() Obrazac gubitka motoričkih neurona opažen kod SMA ukazuje na to da kod SMA s nastupom u dojenačkoj dobi (tip I) liječenje treba započeti što ranije, uključujući već u predsimptomatskoj fazi, prije nego što dođe do znatnog gubitka motoričkih neurona.20
Obrazac gubitka motoričkih neurona opažen kod SMA ukazuje na to da kod SMA s nastupom u dojenačkoj dobi (tip I) liječenje treba započeti što ranije, uključujući već u predsimptomatskoj fazi, prije nego što dođe do znatnog gubitka motoričkih neurona.20
![]() Molekularno gensko testiranje važan je alat za dijagnosticiranje SMA.7, 21
Molekularno gensko testiranje važan je alat za dijagnosticiranje SMA.7, 21
Procjena oblika SMA
Za procjenu prirodnog tijeka bolesti i odgovora na liječenje razvijeno je nekoliko ljestvica za ocjenu motoričkih funkcija.22-24


1. Lefebvre S, Bürglen L, Reboullet S, et al. Identification and characterization of a spinal muscular atrophy-determining gene. Cell 1995;80(1):155-165. | 2. Kolb SJ, Kissel JT. Spinal muscular atrophy. Arch Neurol 2011;68(8):979-984. | 3. Lunn MR, Wang CH. Spinal muscular atrophy. Lancet 2008;371(9630):2120-2133. | 4. National Organization for Rare Diseases. Spinal muscular atrophy. [online] 2012 [cited 2016 Apr 17]. Available from: URL: http://rarediseases.org/rarediseases/spinal-muscular-atrophy/. | 5. Prior TW; Professional Practice Guidelines Committee. Carrier screening for spinal muscular atrophy. Genet Med 2008;10(11):840-842. | 6. D’Amico A, Mercuri E, Tiziano FD, Bertini E. Spinal muscular atrophy. Orphanet J Rare Dis 2011;6:71. | 7. Mercuri E, et al. Diagnosis and management of spinal muscular atrophy: Part 1: Recommendations for diagnosis, rehabilitation, orthopaedic and nutritional care. Neuromuscl Disord 2018;28(2):103-115. | 8. Wirtz PW, Nijnuis MG, Sotodeh M, et al. The epidemiology of myasthenia gravis, Lambert–Eaton myasthenic syndrome and their associated tumours in the northern part of the province of South Holland. J Neurol. 2003;250(6):698–701. doi: 10.1007/ s00415-003-1063-7 | 9. Darras BT, Royden Jones H Jr, Ryan MM, De Vivo DC, eds. Neuromuscular Disorders of Infancy, Childhood, and Adolescence: A Clinician’s Approach. 2nd Ed. London, UK: Elsevier; 2015. | 16. Rothwell E, Anderson RA, Swoboda KJ, Stark L, Botkin JR. Public attitudes regarding a pilot study of newborn screening for spinal muscular atrophy. Am J Med Genet A 2013;161A(4):679-686. | 17. Prior TW, Russman BS. Spinal muscular atrophy. NCBI Bookshelf Web site. [online] 2019 Nov [Cited 2020 Oct 15]. Available from: URL: http://www.ncbi.nlm.nih.gov/books/NBK1352/?report=printable. | 18. MedlinePlus. Spinal muscular atrophy. [online] 2019 [cited 2021 Mar 1]. Available from: URL: https://medlineplus.gov/ency/article/000996.html. | 19. Swoboda KJ, et al. Perspectives on Clinical Trials in Spinal Muscular Atrophy. J Child Neurol. 2007;22:957-66. | 20. Finkel RS. Electrophysiological and motor function scale association in a pre-symptomatic infant with spinal muscular atrophy type I. Neuromuscul Disord 2013;23(2):112-115. | 21. D'Amico A, Mercuri E, Tiziano FD, Bertini E. Spinal muscular atrophy. Orphanet J Rare Dis. 2011;6:71. | 22. Glanzman AM, et al. The Children’s Hospital of Philadelphia Infant Test of Neuromuscular Disorders (CHOP INTEND): test development and reliability. Neuromuscul Disord 2010;20(3):155-161. | 23. Romeo DM, Ricci D, Brogna C, Mercuri E. Use of the Hammersmith Infant Neurological Examination in infants with cerebral palsy: a critical review of the literature. Dev Med Child Neurol 2016;58(3):240-245. | 24. Mercuri E, et al. Patterns of disease progression in type 2 and 3 SMA: implications for clinical trials. Neuromuscul Disord 2016;26(2):123-131. | 25. Spinal Muscular Atrophy Clinical Research Center. CHOP INTEND for SMA Type I score sheet. [online] 2013 Mar [cited 2016 Apr 26]. Available from: URL: http://columbiasma.org/docs/cme-2010/CHOP INTEND for SMA Type I - Manual of Procedures.pdf. | 26. The Pediatric Neuromuscular Clinical Research Network for SMA. Expanded Hammersmith Functional Motor Scale for SMA (HFMSE). [online] 2009 Mar [cited 2016 Apr 25]. Available from: URL: http://columbiasma.org/docs/HFMSE_2019_Manual.pdf.
Biogen-146730 | Lipanj 2022.
