Patofiziologija
Spinalna mišićna atrofija (SMA) rijetka je, nasljedna, autosomna recesivna neuromišićna bolest koju karakterizira degeneracija alfa motoričkih neurona u prednjim rogovima kralježnične moždine, koja dovodi do klinički progresivne atrofije mišića, mišićne slabosti i gubitka pokretljivosti. Najčešći je oblik te bolesti SMA povezan s mutacijama na kromosomu 5q, koji čini približno 95% slučajeva.1,2
SMA je danas jedna od najčešćih i najozbiljnijih genskih bolesti u dječjoj dobi. Za tu je bolest karakteristično da djeca imaju izrazitu slabost gornjih i donjih ekstremiteta, a moguće i slabe bulbarne i dišne mišiće, dok kognitivna sposobnost tih bolesnika naizgled nije narušena.2–6
Trenutno se bolesnici oboljeli od SMA razvrstavaju u pet kliničkih potkategorija (tip 0, I, II, III i IV), definiranih prema dobi pri nastupu simptoma bolesti, težini bolesti i najvećem stupnju postignutih motoričkih sposobnosti. Kod SMA tipa 0 klinički su znakovi primjetni već pri rođenju i to je najteži oblik bolesti, kod koje je očekivani životni vijek kraći od 6 mjeseci.2,7
Procjenjuje se da je globalna prevalencija SMA približno 2 – 6 na 100 000 ljudi, dok procijenjena globalna incidencija na 100 000 živorođene djece iznosi 3,5 - 7,1 za tip I, 1,0 - 5,3 za tip II te 1,5 - 4,6 za tip III.2,7,8 U Europi se godišnja incidencija razlikuje od države do države, kao i prema fenotipu.9
Genska komponenta:
Godine 1995. ustanovljeno je da SMA uzrokuje homozigotna mutacija i/ili delecija gena na kromosomu 5q13, danas poznatom pod nazivom gen za preživljenje motoričkih neurona-1 (SMN1). Ta je genska promjena odgovorna za nedovoljnu proizvodnju SMN proteina, koji je ključan za održavanje motoričkih neurona, što dovodi do progresivne degeneracije tih neurona u kralježničnoj moždini.4,10,12
Međutim, prisutnost drugog gena SMN (SMN2), koji je gotovo identičan genu SMN1 jer se od njega razlikuje u samo 5 nukleotida, omogućuje stvaranje manjih količina SMN proteina. Pritom se proizvodi oko 90% nestabilnog SMN proteina, koji nije funkcionalan i podliježe brzoj razgradnji, te 10% normalnog SMN proteina.2,7,8,10,12
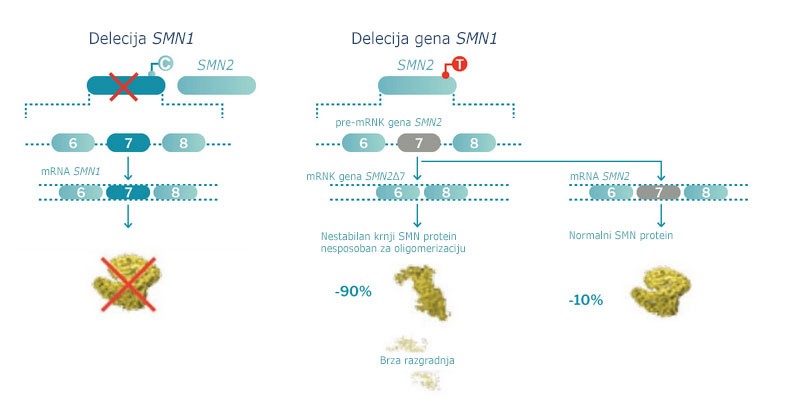
Slika 1. Normalna proizvodnja SMN proteina translatiranog iz gena SMN1 u usporedbi s alternativnim putem, odnosno proizvodnjom istog tog proteina translatiranog iz gena SMN2. Bolesnici oboljeli od SMA nemaju nijedan gen SMN1 i oslanjaju se samo na alternativni put proizvodnje SMN proteina. pre-mRNK: predglasnička ribonukleinska kiselina; mRNK: glasnička ribonukleinska kiselina
S tim u vezi treba naglasiti da je broj kopija gena SMN2 u korelaciji s dobrom prognozom i fenotipom SMA, čak i ako je proizvodnja funkcionalnog proteina iz tog gena nedostatna za preživljenje neurona u središnjem živčanom sustavu (SŽS).1,12
Broj kopija gena SMN2 kod bolesnika sa SMA-om može biti različit, no veći broj kopija općenito je povezan s manje teškom bolešću2:
- Više od 95% osoba sa SMA-om ima barem 1 kopiju gena SMN2.
- Približno 80% osoba sa SMA-om tipa I ima 1 ili 2 kopije gena SMN2.
- Približno 82% osoba sa SMA-om tipa II ima 3 kopije gena SMN2.
- Oko 80% osoba sa SMA-om tipa III ima 3 ili 4 kopije gena SMN2.
Treba ipak napomenuti da, premda je povezan s težinom bolesti, broj kopija gena SMN2 ne predviđa težinu bolesti pouzdano, pa se ne preporučuje donositi odluke o liječenju bolesnika samo na temelju tog podatka.14
1. Lunn MR, Wang CH. Spinal muscular atrophy. Lancet. 2008;371(9630):2120–2133. | 2. Darras BT, Royden Jones H Jr, Ryan MM, De Vivo DC, eds. Neuromuscular Disorders of Infancy, Childhood, and Adolescence: A Clinician’s Approach. 2nd ed. London, UK: Elsevier; 2015. | 3. Arkblad E, et al. A population-based study of genotypic and phenotypic variability in children with spinal muscular atrophy. Acta Paediatr. 2009 May;98(5):865-72. | 4. Prior TW, Spinal muscular atrophy: a time for screening. Curr Opin Pediatr. 2010 Dec;22(6):696-702. | 5. Qian Y, et al. Understanding the experiences and needs of individuals with Spinal Muscular Atrophy and their parents: a qualitative study. BMC Neurol. 2015 Oct 24; 15:217. | 6. Darras BT, et al. Spinal muscular atrophies. Pediatr Clin North Am. 2015 Jun;62(3):743-66. | 7. Kolb SJ, Kissel JT. Spinal muscular atrophy. Arch Neurol. 2011;68(8):979-984. | 8. Islander G. Anesthesia and spinal muscular atrophy. Paediatr Anaesth. 2013;23(9):804-816. | 9. Jones C. PP09.1 – 2352: Systematic review of incidence and prevalence of spinal muscular atrophy (SMA). European Journal of Paediatric Neurology. 2015, 19, Supp 1: S64–S65. | 10. Ogino S, Wilson RB. Spinal muscular atrophy: molecular genetics and diagnostics. Expert Rev Mol Diagn. 2004;4(1):15-29. | 11. Arnold WD, et al. Spinal muscular atrophy: diagnosis and management in a new therapeutic era. Muscle Nerve. 2015 Feb;51(2):157-67. | 12. Genetics Home Reference. SMN1. https://ghr.nlm.nih.gov/gene/SMN1. | 13. Swoboda KJ. Romancing the spliceosome to fight spinal muscular atrophy. N Engl J Med. 2014;371(18):1752-1754. | 14. TREAT-NMD. Diagnostic testing and care of new SMA patients. http://www.treat-nmd.eu/downloads/file/standardsofcare/sma/english/sma_soc_en.pdf.
Biogen-146730 | Siječanj 2022.
